Figura 1. Causas de la disminución del pH lagrimal con el uso de LC.
MIÑONES CONDE M
La superficie ocular mantiene un complejo equilibrio fisiológico en presencia de la lágrima que la cubre, con la que forma un todo. La inmersión de una lente de contacto (LC) en este complejo sistema rompe el equilibrio preexistente, siendo importante conocer la naturaleza de las interacciones lágrima-LC con el fin de eliminarlas o, en todo caso, reducirlas al máximo. Dichas interacciones van a depender, por un lado, de la naturaleza del material empleado para la fabricación de la LC, de su permeabilidad, de los parámetros del diseño y, por otro, de la calidad de la lágrima.
La elección del material para la fabricación de LC ha de hacerse siguiendo criterios de biocompatibilidad, de forma que la LC sea fisiológicamente compatible con el medio en que se inserta. Por otro lado, su diseño ha de permitir adaptarlas física, óptica y fisiológicamente a la superficie ocular, de manera que resulten confortables y permanezcan centradas con respecto a la pupila del paciente, tanto en la fase estática, como durante los movimientos del ojo.
Por todo ello, es imprescindible un estudio profundo de la lágrima en la adaptación de las LC, que se puede conseguir a través de la anamnesis, de un test de lágrima para determinar su cantidad y calidad, de un cuestionario de ojo seco y de un examen clínico. Además, la evaluación lagrimal incluye la observación del borde palpebral y de posibles disfunciones de las glándulas de Meibomio. También, en un examen de rutina, deben incluirse el examen biomicroscópico del resto de la película lagrimal y un menisco lagrimal «normal».
Numerosos estudios, que son expuestos a continuación, demuestran que las LC inducen cambios en las propiedades fisicoquímicas y en la composición de la película lagrimal.
Debe tenerse en cuenta que la formación de la película lagrimal está determinada principalmente por fenómenos fisicoquímicos de superficie, que se alteran por la presencia de las LC.
TONICIDAD
La presión osmótica normal de las lágrimas se considera equivalente a la del suero fisiológico (ClNa 0,9-0,95%), aunque se toleran variaciones equivalentes a soluciones de ClNa de 0,6-1,3%, y más allá de estos límites se produce malestar. La tonicidad de las lágrimas desciende durante el sueño aproximándose a la del suero (290mOsm/l), alcanza su valor más bajo por la mañana después de haber permanecido largo tiempo con los ojos cerrados y se va incrementando en el transcurso del día (1).
La osmolaridad en los sujetos normales es 304 ± 10,4 mOsm/l, y puede elevarse a 340 mOsm/l en el síndrome de ojo seco. Por el contrario, inmediatamente después de la inserción de una LC rígida permeable a los gases (LCRPG) (2) o de una LC hidrofílica (LCH) (3), el lagrimeo reflejo produce hipo-osmolaridad de la lágrima debido al descenso en la concentración de los electrolitos y de las proteínas totales. Este efecto es de corta duración, pues el flujo de producción de lágrima se normaliza en menos de una semana, tras el período de adaptación a la LC. La osmolaridad decrece aproximadamente un 5% con el lagrimeo reflejo. Un descenso acusado de la osmolaridad provoca un paso de agua de menor a mayor concentración, con el consiguiente edema corneal, haciendo que la lente llegue a rozar la córnea; esto sucede sobre todo en la adaptación de LCRPG (de polimetacrilato de metilo). Con el empleo de LCH, es usual una adaptación más rápida, lo que sugiere menos cambios electrolíticos.
Una vez superado el período de adaptación, la osmolaridad de la lágrima se normaliza o incluso se vuelve algo hiper-osmótica. En pacientes adaptados con LCRPG en uso diario, o LCH en uso prolongado, ambas con baja transmisibilidad, se han asociado elevados niveles de osmolaridad de la lágrima, mientras que para los pacientes adaptados con LCH en uso diario la osmolaridad es normal (4).
Estos cambios hiper-osmóticos pueden explicarse por tres mecanismos:
a) Incremento de evaporación inducido por la LC al desestructurarse la película lagrimal.
b) Disminución de la sensibilidad corneal a consecuencia de la hipoxia, que causa una menor producción basal de lágrima.
c) Difusión de depósitos desde la lente hacia la lágrima.
PH Y CAPACIDAD AMORTIGUADORA
El pH de la película lagrimal varía de forma que su valor disminuye cuando se duerme y se alcaliniza a lo largo del día, desde 6,93 a 7,83 (5). El pH se mantiene en este rango debido a la capacidad amortiguadora de la lágrima por su contenido en proteínas e iones bicarbonato (6).
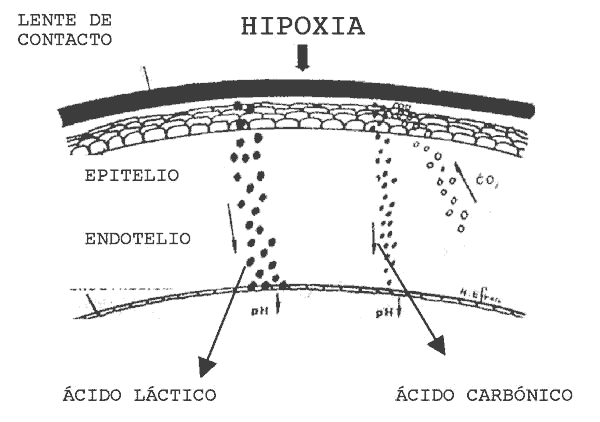
Durante el sueño se produce un cierto grado de hipoxia corneal, en consecuencia la glucosa es degradada de forma anaeróbica dando como resultado la producción de ácido láctico y adenosín trifosfato (ATP), como consecuencia de la producción del ácido láctico, el pH de la lágrima desciende.
De forma similar a lo que ocurre durante el sueño, cuando se inserta una LC se produce cierto grado de hipoxia corneal, lo que provocará una pequeña disminución del pH lagrimal. Además, puesto que el pH disminuye al aumentar el CO2 y otros metabolitos, se puede sospechar que debe disminuir mucho con el uso de LC, pues supone una barrera que retarda el reflujo de CO2 a la atmósfera, dicho CO2 atrapado retrolental reacciona con el agua de la capa acuosa lagrimal y forma ácido carbónico (fig. 1), según la siguiente reacción: CO2 + H2O <—> CO3H– (aq) + H+ (aq).

Figura 1. Causas de la disminución del pH lagrimal con el uso de LC.
Existe mucha controversia sobre si el tiempo de uso de las LC afecta el pH de la película lagrimal. Norm (7) informó que todos los tipos de lentes producen acidificación durante su porte, y en este sentido Tapasztó y cols. (8) encontraron acidificación lagrimal durante el uso de LCRPG. Chen y Maurice (9) admiten un descenso de pH, aunque consideran que tal disminución entra dentro de un rango fisiológicamente normal, por lo que no lo correlacionan con un aumento de CO2 (10). Por otro lado, Carney y cols. (11) no hallaron esta variación e informaron de que la capacidad tamponadora de la lágrima no cambia con el porte de LC.
TEMPERATURA
Cuando se inserta una LC sobre la córnea se altera la estabilidad de la película lagrimal, lo que conlleva un aumento de la tasa de evaporación y consecuentemente una disminución de su temperatura. Esto parece ser así al menos en las LCRPG.
Morgan y cols. (12) han demostrado que la termografía ocular por infrarrojos (fig. 2) puede proporcionar una medida del espesor de la película lagrimal que cubre la córnea. Soh (13) ha adaptado esta técnica para conocer la temperatura de la película lagrimal en la superficie de las LCRPG.

Figura 2. Termografía de un ojo con lente rígida.
Los colores cálidos aparecen donde el espesor lagrimal es mayor y los colores fríos como el azul donde hay mayor adelgazamiento lagrimal. El adelgazamiento se hace más evidente hacia el lado inferior de la LC, donde se supone que la lágrima comienza a romperse. Estos resultados parecen indicar que las LCRPG estudiadas provocan disminución en la temperatura lagrimal. Sin embargo, en el caso de las LCH, así como en las de hidrogel de silicona (LCHS) se observa un aumento de la temperatura de la película lagrimal post-lenticular que parece estar relacionada con el efecto aislante de estas LC. Así, por ejemplo, Martín y Fatt (14) demostraron que las LCH inducen un pequeño incremento en la temperatura de la película lagrimal post-lental.
COMPOSICIÓN
Las LC modifican la composición de las lágrimas durante la fase de adaptación a las mismas, debido al aumento de lagrimeo reflejo, siendo este efecto más acusado durante la adaptación de LCRPG. Los componentes que muestran mayores niveles en el período de adaptación, pero no con el ojo ya adaptado, son las proteínas plasmáticas (como la albúmina, IgG y transferrina), el sodio, el cloro, el potasio y el colesterol.
Se ha sugerido que un elevado nivel de colesterol en lágrimas podría ser la causa de algunas intolerancias a LC (15). Se han encontrado tasas altas de colesterol en pacientes obesos, en embarazadas durante los tres primeros meses y en pacientes tratados con diuréticos, de forma que los portadores de LC, con estas características muestran depósitos grasos en sus lentes, lo que les provoca visión reducida e incomodidad. Los altos niveles de colesterol en lágrimas se correlacionan con elevados niveles de colesterol en plasma.
Por otro lado, se ha demostrado (16) que la concentración de lisozima y lactoferrina es similar entre portadores de distintos tipos de LC y no portadores. Solamente algunos portadores aislados presentan altos valores de estas proteínas lagrimales, lo que puede deberse a una mayor prevalencia de inflamación subclínica corneal y conjuntival en tales pacientes.
Sin embargo, en los usuarios de LC, cualquiera que sea su material óptico, se observa una reducción en el nivel de O2 precorneal, provocando un edema corneal, que puede ser fisiológico o patológico según las características de la córnea de cada paciente. En los portadores de LC de polimetacrilato de metilo (PMMA), esta hipoxia es consecuencia de la impermeabilidad del material. Los usuarios con edema corneal patológico suelen presentar síntomas de hipoxia, lo normal es que refieran borrosidad, que se mantiene al menos 30 minutos tras quitar las LC; sensación de quemazón, dolor, halos alrededor de las luces, ligera fotofobia e incluso intolerancia a las LC. Los signos más evidentes del edema corneal patológico son la pérdida de transparencia corneal central y el aumento de su curvatura y espesor, con lo que se produce un aumento de la miopía o una disminución de la hipermetropía. Esto es muy frecuente en usuarios de lentes rígidas de PMMA; sin embargo, con el empleo de materiales RPG la incidencia del edema corneal suele ser menor, aunque dependerá de que se haga una correcta adaptación (17).
Las primeras LCH que fueron utilizadas para uso prolongado poseían una tasa baja de transmisibilidad al O2 (bajo Dk/t), lo que provocó su prohibición para el uso continuado. Se ha encontrado que el edema hipóxico, después del sueño nocturno, es del 9% al 12%, dependiendo del contenido en agua del material y espesor utilizado, quedando un edema corneal residual entre el 1,6% y 5,1%, pues la córnea se deshincha tan sólo un 8% de promedio (18).
Con LCRPG en uso prolongado, dependiendo del Dk/t del material utilizado, el edema corneal encontrado varía entre el 5% y el 12,9%.
Con LCHS de primera generación el edema corneal encontrado fue 3,7% ± 1,8, siendo éste un valor próximo al valor normal promedio de edema hipóxico durante el sueño sin LC (3,2% ± 1,6) (19). Por ello, Holden y Mertz (18) han considerado que el uso de las LCHS de primera generación no deben producir un grado de hinchamiento corneal que rebase el 4% al abrir los ojos, lo que implica un Dk/t de 87 x 10-9 (cm x ml O2) / (s x ml x mmHg).
El porte de LC en uso prolongado se considera factible si se utilizan LCHS que suministren elevados niveles de O2, lo que conlleva un valor de Dk/t de 125 x 10-9 (cm x ml O2) / (s x ml x mmHg), que al abrir los ojos produciría un edema corneal próximo al que se produce sin LC (3,2% ± 1,6) (19).
RENOVACIÓN DE LA PELÍCULA LAGRIMAL
No se han detectado cambios en la producción lagrimal, inducidos por las LC. Hamano y cols. (20) midieron el volumen lagrimal por la técnica del hilo de algodón a 1.600 portadores de LC PMMA, LCRPG, y LCH, obteniendo una humedectabilidad media de 16,9 mm en 15 seg. Este resultado no difería del obtenido en pacientes no portadores de LC, lo que desde el punto de vista clínico sugiere que las LC no alteran la producción lagrimal, excepto durante la fase de adaptación inicial, en la que hay un aumento de lagrimeo. Sin embargo, aunque la producción lagrimal se mantiene, Tomlinson y Cederstaff (21) hallaron que la evaporación lagrimal se incrementa durante el porte de cualquier tipo de LC, lo que posiblemente se deba a la alteración de la capa lipídica por el uso de lentes.
ESTABILIDAD DEL FILM LAGRIMAL
El conocimiento de la estabilidad lagrimal es una valiosa medida contactológica para predecir o pronosticar el éxito de una nueva adaptación. Se ha demostrado que la estabilidad de la película lagrimal, al igual que el grado de evaporación de la fase acuosa, está relacionada con la estructura de la capa de lípidos. Esta estructura es muy variable entre individuos y puede influir de diferente manera en el control de la estabilidad. Guillon y Guillon (22) proponen un esquema de clasificación de la capa lipídica, vista por reflexión especular con un dacrioscopio, en seis categorías, ordenadas de modo creciente según su espesor:
Marmórea abierta (15 nm-30 nm de grosor, presente en el 21% de la población). Malla abierta y uniformemente repartida. Esta fina capa lipídica favorece la evaporación rápida de la lágrima (fig. 3).
Marmórea cerrada (30 nm-50 nm de grosor, 10% de la población): Malla más cerrada y apretada. La capa lipídica es más gruesa y visible, adecuada para el uso de LC (fig. 4).
Patrón ondulado o fluido (50 nm-80 nm, 23%): Cambio constante en el patrón con una especie de olas grises debido a la pobre mezcla de los lípidos que la componen. Adecuado para el porte de LC (fig. 5).
Patrón Amorfo (80 nm-90 nm, 10%): Aspecto azul-blanquecino altamente reflectante. Capa lipídica completa que puede ser adecuada para el porte de LC, pero con cierta tendencia a acumular un exceso de lípidos (fig. 6).
Patrón de franjas coloreadas de primer orden (90 nm-140 nm, 10%): Se observan franjas de interferencia marrones y azules sobre un fondo gris amorfo. Poco adecuado para el uso de LC (fig. 7), pues implica una producción excesiva de lípidos.
Patrón de franjas coloreadas de segundo orden (140 nm-180 nm, 5%): Se observan franjas definidas, verdes y rojas sobre un fondo gris amorfo. Indica una capa lipídica excesivamente gruesa, no apropiada para el uso de LC (fig. 8).
«Otros» (mayor a 180 nm, 7%): Patrones coloreados muy variables, que no pertenecen a ninguna de las categorías anteriores. Indica un exceso acusado de lípidos, lo que puede contraindicar el uso de LC.
Figura 3. Patrones marmóreos abiertos.
Figura 4. Patrones marmóreos cerrados.

Figura 5. Patrón ondulado o fluido.
Figura 6. Patrón amorfo.
Figura 7. Patrones de franjas coloreadas de primer orden.

Figura 8. Patrón de franjas coloreadas de segundo orden.
Las figuras 3 a 8 corresponden a los distintos patrones lipídicos de la película lagrimal fotografiados con el dacrioscopio «Tearscope®» tras el parpadeo, al detenerse el movimiento hacía arriba de la película lagrimal (23).
En portadores de LC blandas, la fase lipídica observada con el dacrioscopio es similar en espesor y apariencia a la de no portadores, siempre que aquellas carezcan de depósitos; sin embargo, cuando hay depósitos superficiales sobre las LC la película lagrimal se vuelve inestable.
En usuarios de LC rígidas, no existe una capa lipídica bien formada sobre la cara anterior de la lente; sin embargo, en la zona que rodea la lente, sí puede observarse la capa lipídica, lo que podría indicar que el borde de la lente rígida impide la extensión de aquella sobre la superficie de la lente. La destrucción de esta capa lipídica implica un incremento en la tasa de evaporación de la fase acuosa, con el consiguiente aumento de la osmolaridad de la lágrima.
Además, se ha podido establecer una relación entre la composición de la capa lipídica y la estabilidad de la película lagrimal, analizando muestras de distintos pacientes con un cromatógrafo líquido de alta resolución (HPLC), pudo demostrarse el efecto positivo que ejercen los lípidos de alta polaridad con respecto a los de baja polaridad sobre la estabilidad de la película lagrimal. Así, Maissa y cols. (24) comprobaron que en la capa lipídica de no portadores de LC abundan los lípidos de baja polaridad (ésteres de colesterol: 30,2% y colesterol: 25,7%), siendo relativamente escasos los lípidos de alta polaridad (fosfolípidos/triglicéridos: 14%, ácidos grasos: 11,5%). La composición lipídica entre usuarios de LC de hidrogel y no usuarios es diferente: Los usuarios de LC tienen una menor concentración de fosfolípidos/ triglicéridos (usuarios: 8,0%, no usuarios: 18,5 %) y una mayor concentración de colesterol (usuarios: 22,8%, no usuarios: 17,6 %).
Por último, la alteración de las glándulas de meibomio, afecta a la cantidad y calidad de secreción lipídica, pudiendo ser un factor determinante en la formación de depósitos y de intolerancia a las LC. Esta alteración es frecuente, y constituye una de las causas principales de sequedad ocular (25).
ROTURA LAGRIMAL
La estructura de la película lagrimal en usuarios de LC difiere bastante de la que presentan los no usuarios, observándose una reorganización estructural de la película lagrimal al insertar la lente, de modo que ésta queda dividida en película lagrimal pre-lenticular, por encima de la LC y película lagrimal post-lenticular o retrolental, entre la LC y la córnea. Además, la película permanece alterada durante un breve período después de quitarse las lentes. Por ello, el mecanismo de rotura de la película lagrimal sobre la superficie de las LC es diferente de la que tiene lugar en la superficie del ojo, dada la ausencia de capas lipídicas y mucosa bien formadas sobre la lente.
En un ojo sin LC, la película lagrimal permanece estable por lo menos 30 seg.; sin embargo, con LC este valor es mucho menor. Young y Efron (26) estudiaron con un dacrioscopio la estructura de la película lagrimal pre-lenticular sobre la superficie de las LCH con distinto contenido acuoso y observaron que la capa lipídica era muy delgada o inexistente sobre ellas, por lo que el tiempo de rotura lagrimal tenía lugar a los 3-10 seg. Sin embargo en las lentes de mayor contenido en agua, que presentan dicha capa lipídica, se incrementaba el tiempo de rotura, debido al mayor espesor de película lagrimal pre-lenticular. A su vez el tiempo de rotura lagrimal en LCRPG varía normalmente entre 4 y 6 seg. (27), pues al igual que sucede con las LCH, la capa lipídica es extremadamente fina o está ausente en la superficie de estas lentes (28).
El corto tiempo de rotura lagrimal prelenticular (27) sugiere que el adelgazamiento de la película lagrimal pre-lenticular se debe tanto a la evaporación (29) como a fuerzas de tensión superficial que arrastran líquido lagrimal desde la superficie de la lente hacia el menisco lagrimal existente en su borde. Además, la presencia de depósitos en la LC acelerará dicha rotura lagrimal.
La película lagrimal post-lenticular puede visualizarse mediante reflexión especular con la lámpara de hendidura (30), deduciéndose su grosor por el aspecto mostrado con esta técnica, de modo que un patrón amorfo indica una capa lagrimal post-lenticular relativamente gruesa y estable, mientras que los patrones coloreados indican películas lagrimales post-lenticulares más delgadas (31). La fase acuosa (post-lenticular) está algo adelgazada en todas las LC, correspondiendo el mayor espesor, de nuevo, a las LCH con alto contenido en agua.
AGRESIÓN A LA SUPERFICIE OCULAR Y A LAS GLÁNDULAS LAGRIMALES POR LAS LC
Los portadores crónicos de LC pueden desarrollar paulatinamente una patología en el epitelio corneo-conjuntival, que conduzca a una conjuntivitis o a una blefaritis (32). Esto implica que estarán afectadas las glándulas mucosas y lipídicas. Virchow (33), en 1910, demostró que las glándulas mucosas, es decir, las células caliciformes, suelen aumentar en número y producción en situaciones de irritación conjuntival. Este aumento también se ha comprobado en el porte de LC, aunque el incremento de mucinas lagrimales raramente tiene repercusión clínica. En cuanto a las glándulas lipídicas, es decir, las glándulas de Meibomio, y en menor medida, las glándulas de Zeiss y Moll, también se alteran modificando la capa de lípidos de la película lagrimal.
MEDICAMENTOS Y LÁGRIMA EN EL PORTE DE LC
Muchos medicamentos pueden disminuir la secreción lagrimal causando síntomas de ojo seco, e incluso intolerancia al porte de las LC. Estos medicamentos se indican en la tabla 1.

DEPÓSITOS EN LAS LC
En la formación de depósitos intervienen numerosos factores interrelacionados entre sí: el parpadeo incompleto del usuario, las ralladuras excesivas y profundas sobre la superficie de la LC, el material de fabricación, el uso de soluciones de mantenimiento inapropiadas, la presencia de algunas enfermedades oculares y la baja calidad de lágrima.
Así, el exceso de algún componente lagrimal, unido a una alteración en su estructura, favorece la rápida rotura de la película lagrimal conduciendo a la formación de depósitos sobre las LC, siendo las proteínas, los lípidos y el calcio procedentes de las lágrimas los componentes más habituales formadores de dichos depósitos. Las proteínas y los lípidos pueden depositarse sobre la superficie de las LC a los pocos minutos de su inserción, aunque estos depósitos no son visibles y no afectan a la visión, sí pueden reducir la humectabilidad de la superficie de las LC (16), lo que propiciará la existencia de zonas secas sobre la lente, donde se acumularán más depósitos, constituyendo el mejor sustrato para una posible contaminación microbiana.
Los lípidos (colesterol, ácidos grasos insaturados) oxidan los grupos hidroxilos de la LC y la despolimerizan. Estos depósitos lipídicos varían según los materiales de las LC (34), siendo las de silicona las que más fácilmente se contaminan, seguidas de las de hidrogel.
Los depósitos mucoproteínicos de las LCH suelen estar compuestos principalmente por lisozima procedente de la lágrima del usuario, que forma sobre las superficies de la lente una película opaca blanca grisácea, disminuyendo su transparencia. Además, las proteínas se desnaturalizan muy fácilmente dando lugar a reacciones alérgicas.
Los depósitos mucínicos suelen englobar células, cuerpos extraños y gérmenes. Estos tipos de depósitos en forma de bolas de mucina son frecuentes en usuarios de LCHS, su presencia induce cierto tipo de depresiones en la superficie corneal.
El calcio es el mineral que aparece más frecuentemente depositado en la superficie de las LC, aunque los niveles de calcio en lágrima se alteran poco con el porte de las mismas. Parece ser que se necesita que la LC esté previamente contaminada por lípidos para que éstos capturen el cálcio de la lágrima. Según Ruben y cols. (35) la captación de calcio por una LCH puede superar los 0,25 mg/LC, que se depositarán y formarán infiltrados en forma de carbonatos o fosfatos.
También se pueden depositar sobre las LC medicamentos que se eliminen por la lágrima como, por ejemplo, la rifampicina, que teñirá la lente de rosa o naranja (36). Estos fenómenos son importantes en LC, pero pueden solucionarse, al menos en parte, si se siguen las pautas de limpieza y reemplazo recomendadas, pues los depósitos suelen tardar meses o incluso años en hacerse visibles. Sin embargo, es un problema de muy difícil solución en el caso de lentes intraoculares. Para ello es imprescindible el desarrollo de nuevos materiales, o el tratamiento y adecuación de las superficies de los ya existentes.
BIBLIOGRAFÍA