Figura 1. Principales causas de QM (% de riesgo).
PARAFITA MA, GONZÁLEZ-PÉREZ J, GILINO J, GARCÍA-RESÚA C
La infección ocular relacionada con el uso de lentes de contacto (LC) se ha observado desde la introducción de las LC hidrofílicas (LCH) en la década de 1970, si bien no adquiere verdadera importancia clínica hasta 1980, década en la que comienzan a utilizarse para dormir hasta 30 noches consecutivas (principalmente a finales de los 80 con la aparición de las LC de reemplazo frecuente) (1,2). Así, en esta época se asocia el uso prolongado de las LC con un riesgo importante de infección, de tal manera que la FDA y demás organismos internacionales responsables de la regulación del uso de las LC desaconsejan su porte nocturno durante más de 6 noches.
Los cultivos realizados con muestras tomadas de usuarios de LC que padecían queratitis microbiana (QM), mostraron que el agente causal más frecuentemente aislado era alguna bacteria gram-negativa, a diferencia de lo que sucedía habitualmente en los casos de infección ocular hospitalaria (post-traumatismo o enfermedad ocular de diferente naturaleza) en los que la infección era habitualmente debida a bacterias gram-positivas. De las bacterias gram-negativas, la más frecuente era Pseudomonas aeruginosa, caracterizada por presentar una progresión más rápida de lo habitual que dificulta su tratamiento (3,4). Si estos microorganismos no son patógenos habituales en ausencia de LC, puede deducirse que la infección ocular derivada de su porte debe precederse de una alteración del sistema inmunológico ocular causado de algún modo por la presencia de la LC.
Desde la introducción de las LC como alternativa terapéutica con diferentes finalidades, se ha producido un desarrollo continuo en el que se han incorporado nuevos materiales, tratamientos, diseños, geometrías y diferentes modificaciones con el objeto de reducir las complicaciones derivadas de su uso, mejorar su comodidad y representar una alternativa terapéutica más segura y exitosa para un mayor numero de casos. En esta evolución, durante los últimos diez anos se han realizado nuevos aportes que han cambiado espectacularmente la práctica de la contactología y con ello las expectativas de muchos pacientes, siendo los avances mas notables, el lanzamiento de las LC de reemplazo diario (5,6) y sobre todo la introducción de los materiales de hidrogel-silicona.(7) A pesar de estos avances, los estudios más actuales indican que no se ha producido un descenso estadísticamente significativo en el padecimiento de queratitis microbiana por el hecho de usar LC de reemplazo diario (8) o de hidrogel-silicona (9,10). Esto exige una exhaustiva revisión en cuanto a los factores que deben tenerse en cuenta en el desarrollo de nuevas LC y protocolos de adaptación que permitan ofrecer un uso más seguro.
En esta revisión se hace referencia a los aspectos más relevantes de la infección ocular en usuarios de LC, haciendo hincapié en cómo éstas pueden favorecer el riesgo de padecer QM. Asimismo se hace una revisión epidemiológica para presentar la incidencia actual de esta complicación tan relevante.
FACTORES DE RIESGO Y MORBILIDAD
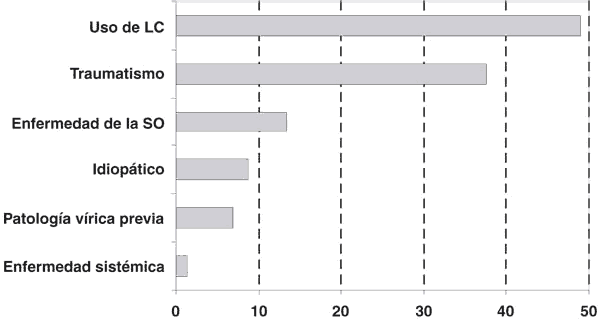
Diferentes estudios epidemiológicos han demostrado que los factores etiológicos más importantes para el padecimiento de QM son el traumatismo ocular (35-40%) y el uso de LC (33-65%). Entre otras posibles causas (fig. 1), aunque con menor frecuencia, se mencionan las enfermedades de la superficie ocular (5,8-21%), la patología ocular vírica previa (6,9%) y determinadas enfermedades sistémicas (1,4%), existiendo también un porcentaje apreciable de casos de naturaleza idiopática (7,9-9,4%) (11-12).

Figura 1. Principales causas de QM
(% de riesgo).
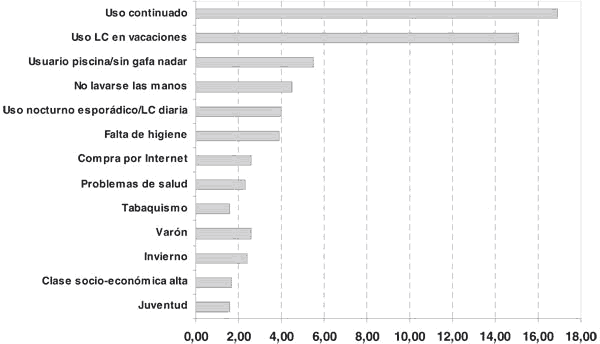
Figura 2. Principales riesgos de
infección en usuarios de LC (39,56,57) (Odds Ratio).
Actualmente más de 100 millones de personas en todo el mundo utilizan LC con diferentes finalidades, siendo numerosas las complicaciones potenciales derivadas de su porte, tanto en uso diario como prolongado (10,13). La infección es una complicación poco frecuente entre los usuarios de LC, aunque se trata de la complicación más grave, pudiendo cursar con diferentes grados de disminución de la visión debido a la ulceración y posterior cicatrización de la córnea en los casos más severos (2,14). Los estudios epidemiológicos proporcionan datos sobre su incidencia, distribución y factores de riesgo para su aparición, permitiendo al contactólogo informar a sus pacientes sobre los riesgos de las LC, en general, y de su uso inadecuado, en particular (10,11,15). Dependiendo de estos factores (13,16), los mecanismos de defensa ocular pueden sufrir alteraciones asociadas a cambios en la flora habitual, posibilitando el crecimiento de determinadas poblaciones microbianas o la colonización por parte de otros agentes potencialmente patógenos. Habitualmente, la infección de la córnea en usuarios de LC es de etiología bacteriana, aunque también puede ser debida a amebas (particularmente agresiva es la Acanthamoeba) y, con menor frecuencia, de naturaleza fúngica o vírica (15,17).
Si se analiza el riesgo de padecer QM en función del uso de diferentes tipos de LC, en sus diferentes modalidades de uso, se observan diferencias significativas. Los estudios estiman que el 90% de los casos han ocurrido con el uso de LCH, el 8% con LC rígidas permeables a los gases (RGP) y el 2% con LC rígidas de PMMA (11). A continuación, pensando en una mayor utilidad clínica, se presentan los datos de incidencia para cada tipo de LC, así como los diferentes factores que puedan influir en su aparición.
LCRPG
Clásicamente, se acepta que el riesgo de QM con el uso de LCRPG es muy bajo, con una incidencia de 1,48-4,0 casos/104 ojos en uso diario, y de 18,0 casos/104 ojos en uso continuado (4,18,19). En la última década, el desarrollo de nuevos materiales de alta transmisibilidad, cada vez más utilizados en uso prolongado, ha reducido significativamente estas cifras hasta incidencias similares a las encontradas para el uso diario de la LCRPG (20-22). Actualmente, puede decirse sin ningún género de dudas que el uso de LCRPG es el que presenta menor incidencia de QM y, por tanto, mayor seguridad frente a la infección ocular. Sin embargo, ha de tenerse en cuenta que se trata del tipo de LC menos utilizada por la población y esto puede tener una importante influencia epidemiológica. Las razones que se apuntan para explicar esta mayor seguridad son que proporcionan un mejor intercambio lagrimal, presentan la menor tasa de adherencia bacteriana e inducen una menor tasa de descamación-apoptosis epitelial (23-25).
LC Hidrogel (LCH)
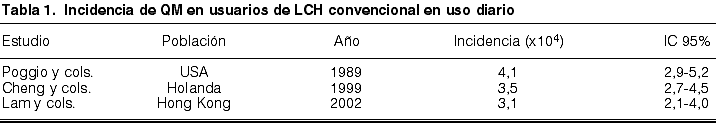
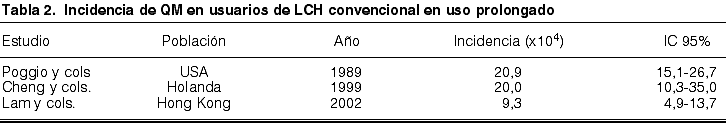
Como puede observarse en las tablas 1 y 2, en 1989, la incidencia anual de QM en EEUU se cifró en 4,1 casos/104 usuarios de LCH en porte diario, aumentando a 20,9 casos/104 usuarios de LCH en uso continuado (2). A raíz de estos datos, la FDA, que en 1981 había aprobado el uso continuado durante 30 días de una serie de LCH, rectifica y limita su porte a 6 días consecutivos. En 1999, los datos de incidencia anual correspondientes a la población holandesa se estimaron en 3,5 casos/104 usuarios de LCH en uso diario y en 20,0 casos/104 usuarios de LCH en uso continuado (4). En 2002, la incidencia de QM en Hong Kong fue de 3,1 casos/104 usuarios de LCH en uso diario y en 9,3 casos/104 usuarios de LCH en uso continuado (26).
Es importante hacer notar que por aquel entonces las LC principalmente empleadas para dormir eran LCH convencionales y de reemplazo frecuente, cuya transmisibilidad (Dk/t), espesor, etc. no cumplían los requisitos para tal uso (27-29). Como puede verse, los datos incluidos en esta revisión pertenecen a diferentes poblaciones, si bien el tamaño de la muestra y la metodología empleada (caracterización de la QM, reclutamiento de pacientes, etc.) son similares, permitiendo establecer razonamientos relativamente fiables, y siendo, por otra parte, los estudios más aceptados actualmente.
Una conclusión, derivada de los diferentes estudios de incidencia de la QM en portadores de LCH en uso diario, es la afirmación de que el uso de LCH incrementa entre 3 y 5 veces el riesgo de padecer QM, y cuando se usan de forma continuada durante 6, 10 o 30 días el riesgo «se incrementa hasta 20 o 30 veces».
El uso de LCH ha sido históricamente la principal causa de QM y se asocia con los cuadros de mayor severidad. Su baja Dk/t, el debilitamiento de la barrera epitelial asociado a una mayor tasa de adherencia bacteriana, junto con un peor intercambio lagrimal se apuntan como las principales razones para explicar la QM. También se relaciona con el mantenimiento inadecuado de las LC en cuanto a limpieza, desinfección, tratamiento enzimático e higiene del estuche porta-LC (1,11,27,30-32).
LCH reemplazo frecuente vs LCH convencional
A finales de la década de los 80, después del lanzamiento de las LCH de reemplazo frecuente, se esperaba una reducción en el riesgo de infección para los usuarios de LCH, pero diferentes estudios han puesto de manifiesto que el riesgo de QM es similar o todavía mayor que en usuarios de LCH convencional tanto en uso diario (33-37). como entre la población que duerme con sus LC (37). Entre los usuarios que hacen uso diario de sus LC, este riesgo incrementado se atribuye al uso nocturno ocasional y al mantenimiento inadecuado (36).
Uno de los avances más notables en la última década ha sido la introducción de las LC de reemplazo diario, con las que también se preveía una reducción en las complicaciones, puesto que con ellas se eliminan los problemas derivados de la manipulación de las LC, así como los riesgos derivados del deterioro de la superficie de la LC. Los estudios más recientes (22) indican que el riesgo de QM es similar entre los usuarios de LC de reemplazo diario que en los usuarios de LCH convencional (tabla 3). Por tanto, puede decirse que las LC desechables, cualquiera que sea su frecuencia de reemplazo, no parecen haber modificado la incidencia de QM.

LC Hidrogel-Silicona (LCHS)
Sin duda, la introducción de las LC de hidrogel-silicona (LCHS), en 1999, es el avance que más expectativas ha levantado en la contactología moderna. Al margen de sus propiedades mecánicas y biocompatibilidad, puede decirse que son las primeras LC que cumplen con los criterios de transmisibilidad al oxígeno, habiendo sido aprobadas por la FDA para su uso durante 30 días consecutivos, lo que implica su uso durante el sueño (27,29).
Por ello, para enfocar adecuadamente el tema, cuando se hable de personas que duermen con sus LC, debe separarse el riesgo de padecer QM que presentan los usuarios de LCH de bajo Dk/t frente a los usuarios de LCHS de alto Dk/t. Los estudios de incidencia (38-40) de QM durante el uso continuado de LCHS revelan una incidencia entre 18,2 y 28,3 casos/104 usuarios (tabla 4).
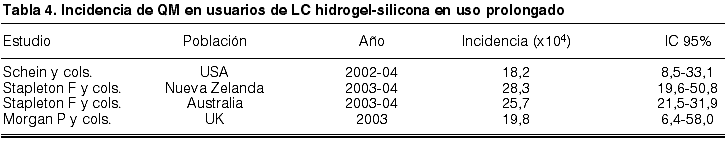
Actualmente, hay datos que permiten afirmar, desde un punto de vista cuantitativo, que los materiales de Hidrogel-Silicona no reducen el riesgo de padecimiento de QM durante el uso continuado de LC en comparación con las LCH convencionales; no obstante, es importante destacar la diferencia en cuanto a la severidad clínica del cuadro en función del tipo de LC utilizada (22), siendo significativamente más severos los cuadros de QM padecidos por los usuarios que duermen con sus LCH convencionales que los que lo hacen con LCHS. La característica que explica este diferente comportamiento, aunque en menor medida que las expectativas depositadas tras su aparición, es el mayor aporte de oxígeno que permite mantener la barrera defensiva innata (41). También se están introduciendo mejoras que proporcionen menor tasa de adherencia bacteriana y, por tanto, menor riesgo de infección (42). Finalmente, cabe señalar que no se han observado casos de QM con el uso diario de LCHS, salvo en adaptaciones en pacientes con diferentes alteraciones subyacentes (22, 43).
LC para ortoqueratología
Otro de los campos en los que se ha avanzado mucho en la última década es el desarrollo de LC con geometrías especiales, preparadas para moldear la córnea de una manera programada y reducir el defecto refractivo del paciente. No existen datos epidemiológicos acerca de la incidencia de QM en usuarios de LC para ortoqueratología (Orto-K) o para terapia refractiva corneal (CRT), por lo que no se puede hablar del riesgo relativo para padecer QM con respecto a otras modalidades de porte. De todas formas, son numerosas las publicaciones en las que se informa del riesgo de QM en pacientes sometidos a terapia de moldeo corneal, principalmente en niños y en la población asiática (44-49). Además, algunos casos tuvieron una perdida significativa de AV.
Dado que muchos de los países (China, Hong-Kong, Taiwan, Japón) en los que se ha detectado una incidencia de QM apreciable presentan un dinamismo importante en la regulación de la práctica de la Orto-K, se han planteado serias dudas sobre la seguridad de tal procedimientos, existiendo diferentes restricciones gubernamentales en la aplicación de esta técnica, como es contraindicar / prohibir su uso en menores de 18 años (50,51).
Otro dato que invita a la precaución es la frecuencia de aparición de Acanthamoeba como agente causal de la infección, siendo aproximadamente del 30% de los casos frente a un 5% de las QM padecidas por los usuarios de LCH (52,53). Se apuntan varias razones para explicar el riesgo de padecer QM en usuarios de LC para Orto-K. El porte nocturno de las LC de geometría inversa induce un adelgazamiento de aproximadamente el 30% del espesor epitelial, pudiendo comprometerse de este modo la barrera defensiva innata frente a la infección microbiana (54). Otros factores que también influyen son el mal estado de los estuches, la presencia de depósitos en las LC, el uso inadecuado de líquidos de mantenimiento, e incluso el uso de agua de consumo doméstico para realizar las tareas de limpieza de las LC.
Otros factores a tener en cuenta en los usuarios de LC
La incidencia de QM también se ve influenciada por factores geográficos y climáticos, e incluso dentro de una misma población se han encontrado diferencias entre localizaciones rurales y urbanas, siendo más frecuente en áreas urbanas (18,55,56). También se ha encontrado que la población de usuarios de LC que padecen QM es más joven que los pacientes que padecen este problema por post-traumatismo u otras causas (10,11,39).
En cuanto al sexo, los hombres parecen presentar un riesgo ligeramente mayor que las mujeres.
Otros factores que incrementan el riesgo son la duración del uso prolongado/continuado de las LC (11), la clase socio-económica alta (11), el tabaquismo (1,39) y la higiene inadecuada en el manejo de las LC (particularmente, en el uso diario de las LC) (11,32,39). También es más frecuente durante los periodos vacacionales, con mayor susceptibilidad en el invierno (56). Durante estos periodos, un porcentaje importante de casos se asocia a las actividades de piscina sin gafas para nadar (10,39). El riesgo de padecer QM también aumenta con la toma de medicación inmunosupresora, de modo que cuando además se asocia al uso de LC el riesgo se incrementa (10). Finalmente, cabe señalar que en la última década ha adquirido especial relevancia la compra de LC a través de Internet, sin la visita previa al contactólogo (39).
Morbilidad
La infección ocular es la complicación más grave derivada del porte de LC. Como acaba de exponerse, existen diferentes factores que condicionan la severidad de este cuadro entre los usuarios de LC. En los casos más severos cursa con la formación de cicatrices que en función de su tamaño y localización pueden causar una mayor o menor perdida de visión (fig. 3). Los casos menos severos, si bien es raro que sean causa de perdida de AV, también se asocian a una morbilidad significativa en términos de padecimiento de dolor, visitas ambulatorias, ingresos hospitalarios, costes del tratamiento e incluso abandono del porte de LC (12).
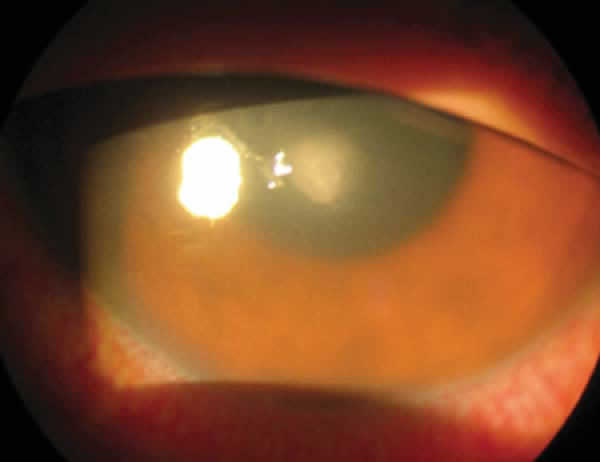
Figura 3. Caso de QM en el que puede
apreciarse ulceración central con perdida de AV.
PREVENCIÓN
La higiene personal y el cumplimiento estricto y responsable de las normas de uso de las LC son dos factores clave en el proceso de adaptación de las LC. Hoy en día se acepta que el uso diario de las LC es el que supone un menor riesgo de infección, especialmente para los usuarios de LCRPG, mientras que si se duerme esporádicamente con ellas el riesgo se duplica, quintuplicándose en aquellas personas que hacen un uso prolongado/continuado. A pesar de los avances introducidos en las últimas décadas, no parece haberse modificado la incidencia de QM; únicamente, los nuevos materiales de Hidrogel-Silicona parecen haber reducido su severidad.
Uso diario
Ni que decir tiene que, en cuanto al riesgo de padecer QM, la recomendación más prudente por parte del contactólogo es aconsejar uso diario de las LC y, de entre todas las posibilidades, el uso de las actuales LCRPG representaría el menor riesgo. De todas formas, es importante hacer referencia a una serie de indicaciones: Lavarse y secarse las manos antes de manipular las LC, reemplazar las LC en las fechas recomendadas por el fabricante o en su defecto por el contactólogo, utilizar únicamente los líquidos recomendados para cada tipo de LC y siempre dentro de la fecha de caducidad, mantener las LC completamente sumergidas durante los periodos de almacenamiento y, por supuesto, no utilizar saliva ni agua corriente para limpiar o preservar las LC.
Uso prolongado/continuado
La realidad es que la praxis del contactólogo viene marcada en cierto modo por el perfil de los usuarios, de tal modo que así como sabemos que en cuanto a preferencia de uso la LC blanda ha desbancado definitivamente a la LCRPG por una cuestión de diseño y comodidad, igualmente es cada vez más frecuente que los usuarios duerman esporádicamente con sus LC o que manifiesten su deseo de dormir con ellas sin necesidad de manipularlas diariamente.
Este hecho exige una reflexión sobre las ventajas de disponer de LC que puedan ser utilizadas de un modo continuo sin ser manipuladas. La ausencia de manipulación de las LC es un factor de seguridad que previene la contaminación microbiana, siempre que las LC sean del tipo recomendado y las características oculares lo permitan. Se piensa que este hecho se debe fundamentalmente a una menor interferencia con la flora ocular normal, que es fácilmente alterada por la manipulación palpebral durante las maniobras de inserción y retirada de las LC. No obstante, cuando las LC se exponen a ambientes adversos, pueden ser potencialmente más peligrosas, lo que podría estar relacionado con una mayor afinidad hacia diferentes microorganismos. Por ello, deben hacerse algunas recomendaciones para no utilizar estas lentes en ambientes propensos a contaminación por microorganismos patógenos, como es el caso del agua de piscinas climatizadas o también del agua de mar, debiendo usarse en estos casos protección adecuada (gafas de piscina). Con mayor motivo que para cualquier otro tipo de uso de LC, debe recalcarse la importancia del reemplazo estricto de las LC tras el periodo de uso recomendado por el fabricante, así como el cumplimiento estricto del calendario de visitas planificado por el contactólogo.
Contrariamente a lo que sucedió en el pasado con las LCH convencionales de baja permeabilidad, desde la aparición de las LCHS, basándose en su alta permeabilidad, se ha especulado con la posibilidad de encontrar una menor incidencia de complicaciones oculares severas con un régimen de uso prolongado y continuo, abriendo así un futuro prometedor para esta modalidad de uso. Como ya se ha indicado, estudios recientes sugieren que aún no existiendo una reducción global en el riesgo de padecer QM con el uso prolongado/continuado de LCHS (57), puede afirmarse que se reduce la severidad de los cuadros (22). La menor incidencia de infección severa en los usuarios de LCHS de alta permeabilidad se debe posiblemente a la mayor integridad del epitelio corneal por estar mejor oxigenado, proporcionándole a la córnea una barrera más eficiente contra las infecciones (27,31). Por ello, a las personas que desean dormir con sus LC debe transmitírsele el mensaje inequívoco de que el riesgo de QM severa es cinco veces menor si utilizan LCHS que con cualquier otro tipo de LCH.
Es importante señalar que tras el lanzamiento de estas LC, algunos estudios (42,58,59) apuntaban una mayor afinidad de ciertos microorganismos en relación con las lentes LCHS de primera generación, lo que suponía un nuevo problema para su uso prolongado. Actualmente se ha demostrado que esta afinidad es significativamente menor con los materiales HS de segunda generación (42). Por el contrario, otros estudios (60) no encuentran alteraciones significativas en cuanto a la contaminación bacteriana de la superficie ocular durante el uso continuo de LCHS de alta transmisibilidad, siendo los microorganismos mas frecuentemente aislados, Staphylococcus epidermidiis y Propionibacterium.
Otra de las cuestiones que genera duda con las actuales LCHS es la planificación del número de noches de uso. Algunos estudios demuestran que la probabilidad de contaminación microbiológica no está relacionada con el numero de noches consecutivas en las que el paciente duerme con las LC, por lo menos durante el primer año de uso, siempre y cuando estas se reemplacen mensualmente (60,61). Parece que mientras que la LC no altere significativamente la homeostasis de la superficie ocular, principalmente el epitelio corneal, un mayor número de noches de uso, no va a provocar un aumento de la incidencia de QM. En este sentido, cabe señalar la ausencia de diferencias en la contaminación microbiana de la superficie ocular con LCH de alta permeabilidad al oxígeno utilizadas en régimen continuo durante un mes en comparación con LCH convencionales en régimen prolongado de seis días (62). De ahí que la importancia de cumplir escrupulosamente con la frecuencia de reemplazo, así como instruir al usuario en la detección de ciertos signos de alarma y planificar adecuadamente las visitas de seguimiento, con el fin de discontinuar el uso de las LC ante cualquier alteración de la superficie ocular.
Ortoqueratología
Dada la escasa información disponible, la primera recomendación preventiva que debería hacerse al usuario interesado en las terapias de moldeado corneal es ponerse en manos de un profesional cualificado. De hecho, el laboratorio no servirá las lentes si el profesional no ha realizado el preceptivo curso de capacitación para este tipo de lentes.
Para disminuir el riesgo de infección ocular durante el porte de este tipo de LC han de cumplirse las mismas recomendaciones dadas para las LCRPG de alta permeabilidad en porte prolongado.
Agente causal y vectores de infección
Desde un punto de vista preventivo es importante conocer la naturaleza y procedencia de los agentes patógenos implicados en la QM de los usuarios de LC. Está suficientemente probada la existencia de una relación entre las bacterias gram-positivas aisladas en las LC y los microorganismos presentes en el borde libre de los párpados con fácil acceso a la LC y a la córnea (63-65). Sankaridurg y cols. (64) analizaron 4321 LC de 330 usuarios, encontrando que la contaminación microbiológica era significativamente menor en las LC de los usuarios asintomáticos que en aquellos que presentan sintomatología. La contaminación de las LC de los pacientes asintomáticos estaba causada por bacterias gram-positivas habitualmente ubicadas en conjuntiva y borde libre de los párpados, como pueden ser Staphilococcus aureus y epidermidis, mientras que en los sintomáticos y/o con presencia de signos (ojo rojo, infiltración, etc.) se encontraban además con cierta frecuencia bacterias gram-negativas junto con Streptococcus pneumoniae, una bacteria gram-positiva.
Diversos estudios indican que las colonias de bacterias gram-negativas encontradas en las LC se relacionan con contaminantes presentes en el agua doméstica usada para la higiene personal, de modo que la manera más probable para el acceso de estas bacterias a las LC y a la córnea sería en el manejo de la LC e incluso debido al uso de agua corriente para su limpieza. Así, durante el procedimiento de colocación de la LC, se produce la contaminación con bacterias gram-positivas provenientes del párpado o gram-negativas procedentes del agua de uso doméstico (63). En consonancia con este razonamiento, se ha observado que el número de microorganismos detectados en la conjuntiva y párpado de los usuarios de LC aumentaba durante los seis primeros meses en régimen diario, estabilizándose entre los seis y los doce meses. Sin embargo, en el grupo de usuarios en régimen prolongado, el número de microorganismos es inicialmente menor y aumenta durante el primer año hasta cifras similares a las encontradas para el uso diario (65). Esta similitud en la contaminación bacteriana de la superficie ocular anterior observada tanto en uso diario como prolongado puede estar justificada por el hecho de que la manipulación de las LC, así como su colocación y extracción, provocan un aumento inicial en la contaminación cuando la LC es utilizada en régimen diario, mientras que el incremento observado durante el uso prolongado se relaciona más con el estancamiento lagrimal en la fase nocturna del porte.
Por todo ello, puede decirse que las vías de contaminación ocular más importantes para los usuarios de LC son: el manejo directo de las LC, el contacto con los microorganismos presentes en conjuntiva y párpados, la posible contaminación de los estuches porta-lentes y en el uso de agua corriente e incluso en los propios líquidos de mantenimiento abiertos durante un tiempo. Paradójicamente, es de reseñar que la mayoría de estos factores están relacionados con la necesidad de retirar las LC para su limpieza y desinfección, principalmente cuando se utilizan en régimen diario. Por otro lado, en aquellas personas que duermen con sus LC, la eliminación de muchos de estos factores no parece ser motivo de disminución de la incidencia de QM, la falta de un cumplimiento estricto de las normas de uso (no bañarse en piscinas con la LC, reemplazo adecuado, usar las LC adecuadas para ello, etc.), junto con el riesgo de contaminación durante el estancamiento lagrimal que tiene lugar por la noche parecen ser las causas de ello.
PATOGENIA ¿CÓMO AFECTAN LAS LC AL SISTEMA DEFENSIVO OCULAR? ¿CÓMO LO APROVECHAN LOS MICROORGANISMOS?
El uso de LC puede presentar diferentes efectos sobre la superficie ocular, tanto desde el punto de vista mecánico a modo de cuerpo extraño adaptado sobre la superficie ocular, como fisiológicamente a modo de barrera a través de la cual debe producirse un nuevo intercambio gaseoso y de diferentes metabolitos. Además, la propia LC puede ser el vehículo de transmisión de diferentes microorganismos. Puede decirse entonces, que una vez adaptadas, las LC condicionan un nuevo equilibrio entre la función palpebral, la secreción lagrimal, la flora microbiana y la integridad defensiva de la córnea frente a los diferentes agentes externos, particularmente microorganismos patógenos. Por todo ello, las LC pueden desequilibrar la flora habitual del ojo y predisponer a la infección (1,11). Clásicamente, los procesos infecciosos pueden clasificarse en: 1) Alteraciones microbiológicas; 2) Alteraciones de los mecanismos de defensa de la inmunidad innata o inespecífica; y, 3) Alteraciones de los mecanismos de defensa inmunológicos adaptativos o específicos. Dado que el uso prolongado de las LC se considera el principal factor de riesgo, en cada apartado se realiza una revisión específica sobre esta materia.
1. Alteraciones microbiológicas
En ausencia de porte de LC, la córnea sana se considera estéril. Ahora bien, debe tenerse en cuenta la existencia de la flora bacteriana residente en conjuntiva y párpados que incluye diferentes microorganismos gram-positivos, siendo los más comunes Staphilococcus, Corinebacterium sp. y Propionibacterium sp. (66). Durante el uso de LCH en pacientes asintomáticos, los microorganismos presentes en las LC son los mismos que se encuentran en la flora microbiana habitual de conjuntiva y párpados (67).
En pacientes con QM no usuarios de LC la infección es frecuentemente debida a bacterias gram-positivas (68). Sin embargo, en usuarios de LC con QM, además de estos microorganismos se encuentra una mayor prevalencia de bacterias gram negativas (12,13,58), siendo la más frecuente la Pseudomonas aeruginosa, caracterizada por presentar una progresión más rápida de lo habitual, que dificulta su tratamiento (3,4).
Actualmente existen suficientes evidencias que señalan a las LC como un vector de transmisión de microorganismos, tanto por provocar mayor retención de los mismos sobre la superficie ocular (estancamiento lagrimal retrolental), como por la propia colonización de la LC por diferentes patógenos (61-63,69,70). También se sabe que las LCRPG presentan la mayor tasa de adherencia bacteriana, aunque son las que permiten una limpieza más eficaz (71). Igualmente, las LC fabricadas con polímeros no iónicos y de alta hidratación presentan mayor susceptibilidad de ser colonizadas por diferentes bacterias (72). La presencia de depósitos sobre el material de la LC, además de poder lesionar levemente el epitelio, favorece también la proliferación de microorganismos. De igual modo, los estuches en donde se guardan las LC pueden contaminarse con cierta facilidad, si no se siguen estrictamente las instrucciones facilitadas por el contactólogo. Estudios recientes estiman en más del 60% los usuarios que no cumplen estrictamente las instrucciones de limpieza y mantenimiento de sus LC (13,70).
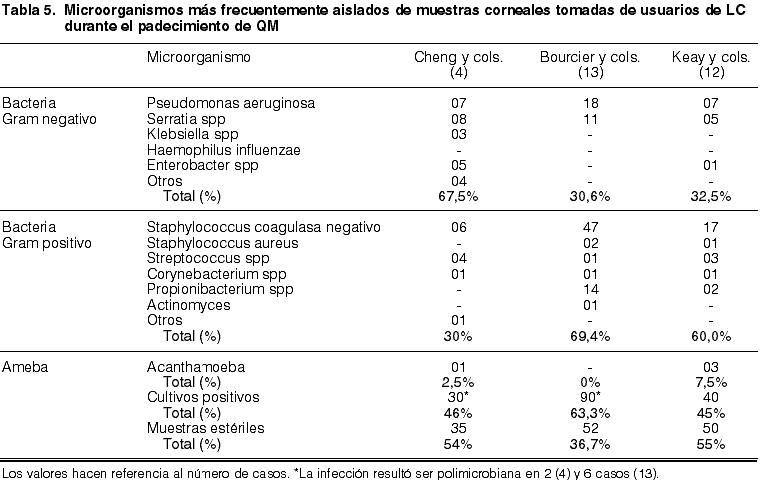
Es evidente que el uso continuado de las LC incrementa los riesgos descritos en cuanto a su participación como vehículo de transmisión microbiológica, por el mero hecho de estar durante más tiempo en contacto con el ojo. No obstante, si se consideran únicamente las LC especialmente diseñadas para dormir con ellas, esto no está tan claro, y así lo demuestran los datos de incidencia de QM severa comentados en apartados anteriores. Hoy se sabe también que las LCHS de segunda generación presentan menor tasa de adherencia bacteriana que las LCH convencionales y que las LCHS de primera generación, por lo que tienen menor carácter vehiculizante (61,62). Además, con el uso continuado se suprime en gran medida la manipulación de la LC y los riesgos de contaminación debidos a su conservación en el estuche. Es de esperar, por tanto, que a medida que se desarrollen nuevos materiales, cuyas características (Dk/t, tratamientos de superficie, geometría, etc.) reduzcan el riesgo de contaminación, se reducirá la incidencia de QM. En la tabla 5 se presenta una compilación de los microorganismos más frecuentemente aislados de muestras corneales, tomadas de usuarios de LC durante el padecimiento de QM.
2. Alteraciones de los mecanismos de defensa innatos
La primera línea de defensa frente a los microorganismos potencialmente patógenos es la denominada respuesta inmune innata, que engloba una serie de elementos, algunos de los cuales tienen por objeto detener la entrada del huésped. Otros, como es el caso de los linfocitos polimorfonucleares neutrófilos (PMN) presentes en la lágrima, tienen por objeto hacer frente a los microorganismos que no han sido detenidos por otros medios y, además, enviar señales a los linfocitos T para preparar la respuesta inmune adaptativa.
Una vez contaminada la LC, el microorganismo necesita invadir la córnea para dar lugar al proceso infeccioso. En este proceso, lo más obvio es la penetración bacteriana por la existencia de un defecto epitelial o su adherencia a la membrana celular, no obstante, no hay que obviar la importancia que puedan tener otras alteraciones de los mecanismos de la inmunidad innata ocular, como es la función palpebral y lagrimal. Son numerosos los estudios (73,74) que indican la existencia de cambios en la amplitud y frecuencia del parpadeo en usuarios de LC, apareciendo la mayor alteración en los usuarios de LCRPG. Este hecho condiciona una peor distribución de la lágrima y un cierto estancamiento retrolental de la misma, induciendo un cierto grado de hipoxia epitelial, debilitando la barrera innata corneal e incrementando el riesgo de contacto con los microorganismos existentes. Además, en los usuarios de LC se instaura una cierta hipoestesia (también mayor en usuarios de LCRPG) que indirectamente incrementa el umbral de estimulación de la renovación lacrimal, pudiendo contribuir a la alteración del mecanismo de limpieza de la superficie ocular y, por tanto, al debilitamiento de la barrera innata. Glasson y cols. (73,74) detectaron diferencias en el mecanismo del parpadeo entre usuarios con buena o mala tolerancia a las LC, así como en otros parámetros relacionados con la estabilidad lagrimal y con síntomas de sequedad ocular. De este modo, cuanto más agresivo sea el uso de LC mayor susceptibilidad tendrá el usuario a desarrollar microtraumatismos en su epitelio, lo que favorecería la infección a través de la pared epitelial debilitada.
En cuanto al riesgo potencial que presentan las LC de causar un defecto epitelial, además de la posible alteración de la función palpebral y lagrimal, destacan la hipoxia, la abrasión epitelial accidental y la toxicidad inducida por diferentes soluciones de mantenimiento y limpieza de las LC. La hipoxia inducida por las LC se asocia frecuentemente con la adaptación cerrada y con el uso continuado de LCH de bajo Dk/t. Se ha demostrado (31) que el uso prolongado de LCH inadecuadas induce un adelgazamiento epitelial progresivo de hasta un 19%, lo que supone un debilitamiento importante de esta barrera. No en vano, en la actualidad, a esta población de usuarios de LCH se le atribuye el mayor riesgo de infección asociada al porte de LC. Por combinación de cualquiera de los factores etiológicos descritos, el daño epitelial también produce mayor presencia de fibronectina, que por su afinidad por los microorganismos ha sido propuesta como un factor potenciador de la infección ocular en casos de traumatismo corneal (75). No obstante, su incremento podría asociarse a un mecanismo protector similar al ejercido por la mucina, facilitando la eliminación de microorganismos adheridos por su disolución en la lágrima.
La respuesta inmune innata utiliza diferentes elementos para eliminar los agentes invasores, incluyendo varias enzimas de las que destacan la lisozima, la lactoferrina y la fosfolipasa A2 en lágrima. Como ya se ha indicado, las alteraciones de producción y distribución lagrimal pueden reducir la eficiencia de los agentes antimicrobianos y de limpieza de la superficie ocular. Diferentes estudios apuntan que aunque existen diferencias en cuanto a la tasa de adherencia de la lisozima a los diferentes materiales de LC (76), la concentración de lisozima y lactoferrina libre en la lágrima de usuarios de LCH, no disminuye significativamente y por tanto puede cumplir su función antimicrobiana durante el porte de LC (73,74,77,78). Por otro lado, la deposición de estas y otras proteínas sobre la LC durante su uso, no parece inhibir la adherencia bacteriana, e incluso podría favorecer el anclaje de diferentes bacterias gram-negativas a la superficie de la LCH, particularmente durante el uso continuado de las mismas (79).
3. Alteraciones en los mecanismos inmunológicos específicos
En este apartado se refieren diferentes elementos inmunes presentes en la superficie ocular, como son las inmunoglobulinas, células inmunocompetentes y diferentes mediadores de la inflamación.
Existen evidencias de que la concentración de lgA secretora se encuentra alterada en los usuarios de LC tanto en uso diario como continuado. Es bien conocido que la lgA secretora es un agente eficaz en la respuesta del huésped frente a los microorganismos, su alteración debilita la defensa inmunológica de los usuarios de LC frente a diferentes patógenos entre los que se encuentra la Pseudomonas aeruginosa (80,81).
En cuanto a los diferentes mediadores de la inflamación, el factor C3 del complemento no cambia de concentración durante la utilización de LC. También se ha observado que la concentración de interleukina-8 aumenta en usuarios de LCH de bajo Dk/t que duermen con sus lentes. El factor inflamatorio y angiogénico 12-HETrE también aumenta su concentración durante la utilización de LC, sobre todo si se asocia a hipoxia o traumatismo (82).
Por otra parte, la utilización de LC está asociada al mayor reclutamiento de linfocitos en la superficie ocular, sobre todo durante su uso continuado. Diferentes estudios experimentales han demostrado un menor reclutamiento de PMN en infecciones oculares en usuarios de LC frente a infecciones de otra naturaleza. Esta hecho se atribuye a la existencia de una alteración en los mecanismos quimiotácticos necesarios para el reclutamiento de PMN, pudiendo instaurarse así, una mayor susceptibilidad de la superficie ocular a las infecciones (58).
Durante el uso continuado de las LC hay que tener en cuenta una serie de particularidades. Durante la noche, con el ojo cerrado, la secreción lacrimal se reduce significativamente por disminución del mecanismo de estimulación refleja, de ahí que durante el sueño los mecanismos de defensa contra la infección se reduzcan significativamente. Además, debe tenerse en cuenta que parte del oxígeno que llega a la córnea, lo hace a través de los capilares del tarso. Por ello, el ojo va a poner en juego diferentes factores encaminados a una mayor vigilancia inmunológica frente a los microorganismos. La concentración de lisozima y lactoferrina permanecen constantes o se reducen ligeramente durante el cierre palpebral. La mucina aumenta significativamente contribuyendo a un aumento de la viscosidad de la lágrima. También aumenta la lgA secretora hasta representar casi un 80% de las proteínas totales de la lágrima (83-85). Por último, se liberan diferentes elementos cuya misión es la de reclutar una mayor cantidad de células inmunocompetentes durante el sueño (82,86,87).
Al igual que sucede con otras células inmunocompetentes encargadas de la captación y presentación de antígenos, las células de Langerhans no están habitualmente presentes en la córnea, sino que residen periféricamente en la conjuntiva. Varios estudios muestran que el uso de LC provoca un aumento en la densidad de estas células en la córnea, principalmente durante el periodo inicial de la adaptación, probablemente debido a la irritación mecánica provocada por la LC (88). Además, se ha observado que el uso prolongado de LC puede provocar la migración centrípeta de las células de Langerhans desde el epitelio conjuntival hacia la región central y paracentral de la córnea (89,90). El reclutamiento de estas células es masivo en individuos que padecen QM, observándose principalmente en las áreas de lesión (91). La presencia de estas células en la córnea sirve para responder más rápidamente y con mayor intensidad ante la presencia de una noxa, así como para contribuir a activar la respuesta inmune del individuo frente al huésped.
BIBLIOGRAFÍA