
GONZÁLEZ PÉREZ J, LÓPEZ JM, GARCÍA RESUA C, PARAFITA MA
SUMMARY
PERIPHERAL ULCER ASSOCIATED WITH STERILE HIGH Dk HYDROGEL SILICONE CONTACT LENS CONTINUOUS WEAR
Case Report: A case of a 21-year-old female who presented symptoms of discomfort, ocular irritation, foreign body sensation, photophobia and lacrimation. The biomicroscopy examination shows a moderate conjunctival and limbal hyperemia. A single small circular lesion appears at 3 mm from de limbus in the paracentral inferior cornea, associated with sub epithelial stromal infiltrate. Normal ocular biota was recovered from the CL and lens care products from the affected eye. The lesion resolved following medical therapy with a broad spectrum antibiotics during 3 days and discontinuation of lens wear for 7 days with the result of a slight scar.
Conclusions: Although it is mostly observed in patients who wear lenses on an extended wear basis, he CLPU is an infrequent inflammatory corneal reaction, especially in a subject wearing silicone hydrogel lenses. The possible etiologies of CLPU in this case are discussed, including mechanical irritation, debris trapped behind CL and non detected toxins released by microbial fauna colonizing the CL surface.
Key words: Infiltrative keratitis, corneal sterile infiltrate, corneal peripheral ulcer, extended/ continuous wear, hydrogel-silicone CL.
RESUMEN
Caso Clínico: Paciente de 21 años usuaria de LC hidrogel-silicona de alto Dk en porte prolongado, que consulta por incomodidad, irritación ocular, sensación de cuerpo extraño, lagrimeo y fotofobia en OD. Al biomicroscopio muestra moderada hiperemia conjuntival y limbal. En la córnea presenta pequeña erosión epitelial circular de localización paracentral inferior a 3 mm del limbo, rodeada por una banda de infiltrado difuso. Las pruebas microbiológicas fueron negativas en la LC y líquidos de mantenimiento. Se aplicó antibioterapia local de amplio espectro y retirada de la LC durante 7 días, dejando una cicatriz leve tras su resolución.
Conclusiones: La úlcera periférica por LC de naturaleza estéril aparece principalmente en usuarios de LC en uso prolongado, si bien, en líneas generales es una complicación infrecuente, siendo escasos los casos registrados en portadores de LC de hidrogel-silicona de alto Dk. Se discuten, como posibles causas, el efecto de toxinas bacterianas y/u otros productos sobre un epitelio susceptible, tal vez debido a la irritación mecánica y a la acumulación post-lental de metabolitos.
Palabras clave: Queratitis infiltrativa, infiltrado corneal estéril, úlcera corneal periférica, uso continuado/prolongado, LC hidrogel-silicona.
INTRODUCCIÓN
Antes de la utilización de las lentes de contacto (LC) para corregir las ametropías, la mayor parte de las úlceras corneales se relacionaban con traumatismos, infecciones oculares o enfermedades sistémicas con repercusión ocular (1).
La úlcera corneal es una de las complicaciones más serias derivada del porte prolongado de LC (2-4). Actualmente muchos casos de úlcera corneal (9% al 66%) se asocian al porte de LC (5-8). Su frecuencia de aparición, en relación con el tipo de porte y régimen de reemplazo, ha sido bien estudiada, encontrándose el mayor índice de riesgo en el porte prolongado de LC hidrogel (7 a 15 veces mayor que el porte diario) (7-10). Con la aparición de las LC desechables, en 1984, se esperaba una fuerte reducción de esta complicación durante el uso prolongado (UP). Sin embargo, la incidencia de úlcera asociada con el porte de LC de reemplazo frecuente (11) aumentó del 20% en 1989 al 39% en 1994, lo que probablemente no indicaba otra cosa que un aumento notable en el número de usuarios de este tipo de LC (11-15). Actualmente se sabe que el porcentaje de úlceras asociadas con el porte de LC desechables o de reemplazo frecuente es similar (16-18), o algo menor (7) que con LC convencionales. Recientemente se han desarrollado y comercializado las LC de hidrogel-silicona (LCHS) de alto Dk, apreciándose una reducción importante en la frecuencia de aparición de queratitis (19-22). La severidad de los cuadros de úlcera corneal asociada al porte de LC es diversa, yendo desde úlceras centrales extensas de naturaleza infecciosa (frecuentemente debidas a P. aeruginosa) a pequeñas erosiones periféricas acompañadas de infiltración estromal anterior (con frecuencia de cultivo negativo) y etiología bastante desconocida.
La presencia de infiltrados corneales en relación con el porte de LC es la complicación más frecuentemente observada en portadores de LC (2). La presencia de infiltrados en estroma, asociados o no a daño epitelial, y en ausencia de cualquier otro signo patológico, suele ser un cuadro benigno (23) que en el usuario de LC suele remitir tras la retirada de las mismas. No obstante, ha de tenerse en cuenta que este signo puede aparecer también en el curso de una queratitis infecciosa asociada a LC que deberá ser tratada adecuadamente para su correcta resolución. Se consideran infiltrados estériles aquellos infiltrados corneales no relacionados con la presencia de microorganismos y de curso habitualmente asintomático (19,23) o con sintomatología florida como ocurre en el ojo rojo agudo asociado a LC (24) y en la úlcera periférica asociada a LC (UPLC) (25). Actualmente se acepta que los criterios clínicos, fruto de datos epidemiológicos, son útiles para el diagnóstico diferencial entre infiltrados corneales de causa infecciosa e infiltrados estériles (tabla 1). Diversos autores (25-30) caracterizan la queratitis estéril como una reacción inflamatoria de cultivo negativo, pequeño tamaño, lesión epitelial limitada o ausente, Tyndall moderado o inexistente, e incomodidad más que dolor. Por el contrario, los infiltrados corneales de cultivo positivo asociados a daño epitelial (úlcera infecciosa) se presentan con dolor, mayor respuesta inflamatoria, secreción, tinción epitelial y reacción en cámara anterior (27).

La UPLC se define como una reacción inflamatoria aguda caracterizada por lesión epitelial e infiltración estromal anterior difusa (25), sin perforación de la membrana de Bowman (31), causante de inflamación moderada y cuya resolución deja escasas secuelas cicatriciales. Se asocia al UP y su incidencia se cifra entre 1,1 y 13% (12,32). La menor incidencia se ha encontrado con LCHS de alto Dk (21). Las UPLC, y en general, los infiltrados corneales son raras en portadores de LC rígidas permeables al gas (LCRPG) (17,33). Más frecuentemente se relacionan con el porte prolongado de LCH convencionales (34) y desechables (14,16,35). La etiología de la UPLC de cultivo negativo no está del todo aclarada, diferenciándose de las úlceras de etiología infecciosa por su naturaleza, severidad y posibles consecuencias.
El propósito de este artículo es la exposición de un caso de infiltrado corneal único asociado a lesión epitelial completa durante el porte prolongado de LCHS de alto Dk (lotrafilcon A) con reemplazo mensual (tabla 2). Como no hace mucho tiempo que esta LC ha sido aprobada para el porte prolongado durante 30 días consecutivos por la FDA, la presentación de este caso permite discutir la posible relación de causalidad entre las LCHS y el desarrollo de infiltrados corneales asociados a daño epitelial, así como las características de su presentación clínica y su manejo.
CASO CLÍNICO
Paciente de 21 años portadora de LCHS de alto Dk en UP (30 días - 29 noches) desde hace 4 meses, con reemplazo mensual. Antes había usado LC hidrogel de reemplazo frecuente en porte diario durante 5 años.
Al levantarse por la mañana presentó un cuadro de irritación ocular inusual, sensación de cuerpo extraño, lagrimeo y fotofobia en el OD. Ese mismo día acude a consulta con la sintomatología descrita. La AV es 20/20 con su gafa aunque con ligera borrosidad en su OD.
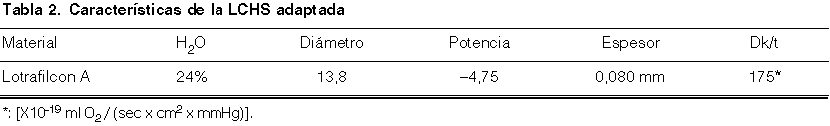
En la exploración del segmento anterior se aprecia moderada hiperemia bulbar y limbar del OD, incrementada con referencia a los valores pre-adaptación y, en todo caso, mayores que los correspondientes al OI. Se aprecia erosión epitelial circular paracentral inferior (270º), a 3 mm del limbo, y de 0.8 mm de diámetro (aprox.), rodeada de un infiltrado difuso claramente apreciable tras instilación de fluoresceína (fig. 1).
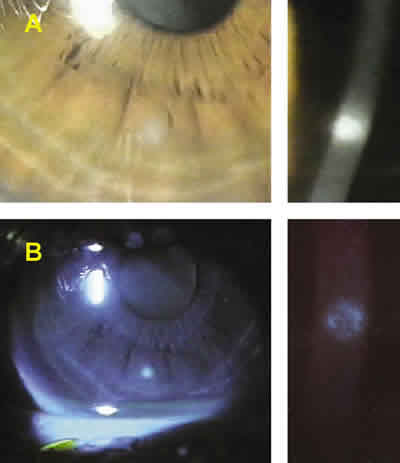
Figura 1. UPLC de morfología circular, ubicación medio-periférica (A) e
intensa con fluoresceína (B).
Debido a las características del infiltrado y a la existencia de daño epitelial que afecta a todo su espesor se confirma la presencia de UPLC. Se envía la LC y el estuche con su líquido de mantenimiento al Laboratorio de Microbiología para tinción Gram, Giemsa y cultivo microbiológico (agar-sangre, chocolate-agar y tioglicolato). Las pruebas de laboratorio enfocadas hacia la detección de hongos, bacterias (aerobios y anaerobios) y amebas resultan negativas, lo que en principio descarta su etiología microbiana.
Se vigila cada 48 h el caso observándose que a los 6 días la reepitelización es completa, no se aprecia tinción con fluoresceína, ni infiltrado difuso, y desaparecen por completo los signos de inflamación. Durante la semana siguiente se realiza una nueva revisión antes de retornar al uso diario de una nueva LC desechable. La secuela de esta UPLC se limita a un leucoma, que no afecta a la visión por situarse periféricamente a la zona óptica central.
DISCUSIÓN
El cuadro clínico corresponde a un infiltrado estromal estéril con daño epitelial (26,29,30) denominado UPLC (12,18). Esta entidad se caracteriza por la existencia de una lesión circular localizada en la media periferia, de pequeño tamaño (inferior a 2 mm), con afectación epitelial focal (pérdida celular parcial o total) y asociada a infiltración celular estromal-subepitelial. Los síntomas asociados son irritación ocular moderada, dolor leve, sensación de cuerpo extraño, fotofobia y lagrimeo. Diversos estudios han demostrado que el infiltrado estromal anterior está conformado por células inflamatorias (principalmente PMN), que migran desde los vasos límbicos y desde la lágrima en respuesta al estímulo quimiotáctico desencadenado por la liberación de sustancias en el proceso de daño epitelial y sin perforación de la membrana de Bowman (23,31,36). Este caso confirma la ubicación medio-periférica de estos infiltrados (18,30).
Aunque ya se ha descrito algún caso de UPLC en portadores de LCHS (37), este es uno de los pocos casos presentados en portadores de LCHS de alto Dk en uso continuado.
La etiología de la UPLC no está del todo clara. Muchos estudios realizados con LC hidrogel señalan que pudiera ser debida a la hipoxia, puesto que se encuentra con mayor frecuencia en porte prolongado que en porte diario (10,31,38). Además, aunque puede aparecer en cualquier localización, se ubican preferentemente en el hemimeridiano superior de la córnea (30), menos oxigenado y más delgado que el resto. Nilsson (17) observa que el porte nocturno de LC es el mayor factor de riesgo para el padecimiento de queratitis ulcerosa, sugiriendo que la queratitis infecciosa suele presentarse en usuarios de LC convencionales, mientras que la UPLC de cultivo negativo lo hace en usuarios de LC de reemplazo frecuente. Actualmente se sabe que las LCHS de alto Dk han conseguido disminuir las complicaciones derivadas de la hipoxia (37-40). No obstante, algunos estudios indican que durante el porte prolongado de LCHS pueden ocurrir complicaciones no asociadas con la hipoxia, entre las que se encuentra la UPLC (37) y la lesión epitelial arqueada superior (41).
Por otra parte, se ha apuntado que la UPLC podría ser una reacción inmunológica frente a los productos de diferentes microorganismos (mecanismo de daño tisular de causa inmunológica de tipo III), existiendo casos de asociación entre UPLC y líquido de mantenimiento contaminado, entre UPLC y cultivo de la propia lesión o entre UPLC y LC contaminada (26,37). En este sentido, se han encontrado evidencias que asocian el desarrollo de UPLC con contaminación bacteriana de la LCHS (19,42). No obstante, además del presente caso, existe múltiples estudios mostrando la presencia de UPLC activa asociada a cultivo negativo de las LC, de los líquidos de mantenimiento, y de las muestras tomadas de la lesión (18,26,31).
Imayasu y cols (43) han demostrado una buena correlación entre la transmisibilidad al oxígeno (Dk/t) de las LC y la adhesión corneal de P. aeruginosa en conejos sujetos a porte nocturno de LC, encontrando que cuanto mayor es la Dk/t menor es la tasa de adhesión. Ren y cols (44) encontraron también adherencia de P. aeruginosa a células corneales en conejos portadores de LC, disminuyendo la adherencia al aumentar el Dk/t de la LC. Estudiaron el índice de adhesión de P. aeuroginosa en LCHS de alto Dk, concluyendo que éstas suponen un menor factor de riesgo para el padecimiento de queratitis infecciosa que las LC hidrogel convencionales (22). Así pues, parece claro que la hipoxia puede ser factor etiológico directo (afectación epitelial) o indirecto (facilitando la infección bacteriana) de UPLC en usuarios de LC hidrogel convencionales o desechables, sobre todo en UP.
Diferentes estudios muestran los efectos del UP de LC hidrogel de diferente Dk sobre el epitelio corneal, encontrándose una disminución en la captación de oxígeno medioambiental, un adelgazamiento epitelial significativo y una menor tasa de recambio (45,46). El UP de LCHS cursa con adelgazamiento epitelial del 7% durante los primeros 4 meses (aunque se recupera parcialmente con el tiempo) (22). Asimismo, se ha apreciado una hipertrofia epitelial significativa en los primeros seis meses, sin recobro aparente durante el primer año y con un descenso en la tasa de exfoliación del estrato más superficial del epitelio. Estos hallazgos no pueden ser atribuidos a la hipoxia, mientras que podrían ser debidos a la acción del efecto mecánico de la LC, junto con la alteración de los metabolitos y detritus presentes en la lágrima sobre el epitelio (22,47).
En el presente caso, después de cuatro meses de UP, la paciente no presentaba signos derivados de la hipoxia, y dadas las características de la LC se ha descartado este factor etiológico. Asimismo, los resultados de las pruebas del laboratorio microbiológico resultaron negativas para los microorganismos aislados con más frecuencia en las úlceras corneales. Todo ello sugiere que otros factores distintos de la hipoxia e infección pueden causar daño epitelial e infiltración.
Los materiales de la LCHS, con mayor módulo de elasticidad e incorporación de una cubierta hidrofílica, confieren mayor rigidez a estas LC que la de las LC hidrogel convencionales (48), causando mayor efecto mecánico sobre la superficie ocular. De hecho, diferentes estudios han evidenciado complicaciones en la superficie ocular, incluyendo el moldeo corneal con tendencia al aplanamiento central (49) o la lesión arqueada epitelial superior (41), que probablemente en conjunción con otros factores desencadenantes influya en el desarrollo de UPLC.
Las LCHS se asocian con una inadecuada acumulación de metabolitos entre la cara posterior de la LC y la córnea. La naturaleza y formación de estos residuos es poco conocida, si bien se cree relacionada con un intercambio lagrimal postlental defectuoso y con una inadecuada humectabilidad de su superficie (material y diseño). Se han descrito residuos lipídicos y de mucina (bolas de mucina) en usuarios de LCHS de alto Dk. Estos residuos de mucina pueden ser causa de indentación de la superficie epitelial (50,51).
Todo parece indicar que la UPLC tiene lugar en el marco de una reacción inflamatoria consecuencia de una agresión epitelial. El efecto de toxinas de bacterias contaminantes del borde libre de los párpados (fig. 2), junto con diferentes factores que afectan al epitelio, pueden considerarse la causa de la UPLC. Recientemente, se ha señalado como principal causa a las toxinas producidas por el S. aureus (52).
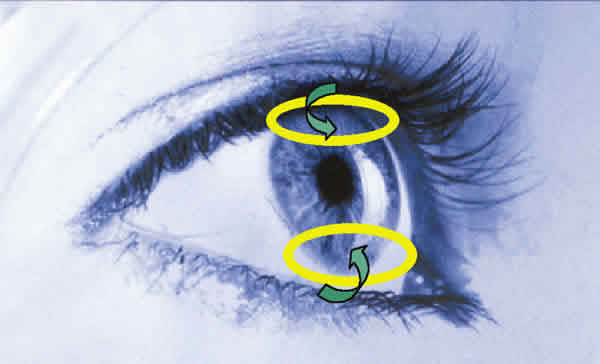
Figura 2. Áreas de localización de la UPCL en donde actúan las toxinas
liberadas por las bacterias del borde libre u otras proteínas degeneradas de
acumulación post-lental.
La posible alteración del equilibrio de la flora microbiana, la interacción mecánica de la LC con la superficie ocular, así como una inadecuada acumulación de metabolitos debida a un intercambio lagrimal defectuoso deben considerarse como posibles factores desencadenantes, condicionados tanto por el material y diseño de las LC como por las características del paciente.
Los infiltrados corneales periféricos suelen estar bien delimitados y resolverse espontáneamente sin terapia farmacológica tras la retirada de la LC (18). Ante la observación de erosión epitelial completa es prudente tratar este cuadro con antibióticos de amplio espectro durante dos o tres días. Una vez cicatrizado el epitelio, si se mantiene el cuadro inflamatorio debe considerarse la administración tópica de antiinflamatorios esteroideos. Cuando esto sucede debe retirarse momentáneamente la LC y una vez restaurada la integridad corneal valorar el mantenimiento del UP con menos noches de uso. En caso de recidiva se recomienda prescribir una LC en porte diario.
Las características de las actuales LCHS de alto Dk han conseguido disminuir el riesgo de complicaciones derivadas de la hipoxia, pero se conoce poco del riesgo que suponen para desarrollar complicaciones de causa diferente. Los requerimientos estéticos y visuales de los usuarios de LC hacen que las LC en porte prolongado sean cada vez más demandadas. Por ello, los contactólogos han de ser cada vez más responsables en la adaptación de este tipo de LC, siendo imprescindible realizar un adecuado seguimiento de los pacientes para detectar precozmente cualquier complicación.
BIBLIOGRAFÍA